УДК 541.183
В.С. Морозов, Д.В. Морозов, Е.В. Морозов
ЗАО «Научно-техническое агентство «Наука»
129226, Россия, г. Москва, ул. Сельскохозяйственная, 12.
О РАССТВОРИМОСТИ АЗОТА В ЖИДКОМ ВОДОРОДЕ И ЕГО ОЧИСТКЕ АДСОРБЦИЕЙ
При рассмотрении жидкого водорода в качестве товарного криопродукта необходимо учитывать возможную его загрязнённость микропримесями, в частности азотом. Литературные данные по этому вопросу весьма противоречивы. В настоящей работе независимым оригинальным методом получены термодинамически согласованные экспериментальные данные о растворимости твёрдого азота в жидком водороде. В интервале температур от 20,3 до 28,0 К растворимость изменяется от 0,45 до 23,4 ppmᵥ. Одновременно исследованы адсорбционные равновесия в системе азот — жидкий водород — силикагель АСМК-ВС, результаты которых позволяют рекомендовать для очистки жидкого водорода от примеси азота метод адсорбции.
Ключевые слова: водород жидкий, азот твёрдый, растворимость, адсорбция, очистка.
Talking about liquid hydrogen as a marketable cryoproduct it’s necessary to consider its potential contamination with micro admixtures, in particular with nitrogen. All known information concerning this matter is very contradictory. In present study we obtained by independent original method the experimental data thermodynamically corresponded about dissolubility of solid nitrogen in liquid hydrogen. Within the limits of temperature from 20,3 up to 28,0 K dissolubility varies from 0,45 to 23,4 ppmᵥ. At the same time adsorption balances were explored in the system nitrogen-liquid hydrogen-silica gel ACMK-BC, and the results allow recommend an adsorption method for purification of liquid hydrogen from nitrogen admixture.
Key words: liquid hydrogen; nitrogen firm; solubility; adsorption; purification.
I. ВВЕДЕНИЕ
В области жидкого состояния водорода все вещества, кроме гелия и неона (температура тройной точки неона 24,5 К), являются твёрдыми. Их склонность к растворимости в жидком водороде весьма различна. Растворимость таких веществ как Н₂О, СО₂, SO₂, H₂S, NO, NO₂, углеводороды тяжелее CH₄ и др., по нашим приближённым оценкам, является ничтожно малой (менее 10⁻⁵…10⁻¹⁰ ᵥppt). Поэтому смеси таких веществ с жидким водородом можно рассматривать только в виде суспензий. Принципиально иную картину можно наблюдать относительно примеси азота в жидком водороде, если принять во внимание самую последнюю по времени опубликования информацию, представленную в графическом виде в работе [1] о его растворимости в жидком водороде. Однако, информация [1] отличается от известных и вошедших в справочные издания экспериментальных данных и оценок (см., например [2,3,4]).
Цель настоящей работы состояла в том, чтобы определиться с действительными значениями растворимости твёрдого азота в жидком водороде и, при необходимости, предложить соответствующий метод его очистки.
II. МЕТОДИКА ИЗМЕРЕНИЙ И ЕЁ АППАРАТУРНОЕ ОФОРМЛЕНИЕ
Экспериментальное исследование фазовых равновесий в системах твёрдое вещество — жидкость при криогенных температурах связано с преодолением определённых трудностей. Одна из них связана с получением насыщенных растворов. При этом используют статический, циркуляционный или динамический методы, обладающие своими достоинствами и недостатками. В своё время на основании анализа этих методов применительно к криогенным системам нами отдано предпочтение динамическому методу (методу потока).
Однако, из корректно полученного насыщенного раствора необходимо отобрать пробу и проанализировать её. Здесь возникает трудность, обусловленная наличием фазовых превращений на пути движения полученного насыщенного раствора к анализатору. Данное обстоятельство может приводить к искажению состава пробы вследствие значительно меньшей, при одинаковых условиях, растворимости данного твёрдого вещества в паре, чем в жидкости. Действие этой причины исключается, если давление в исследуемой системе выше критического давления растворителя. Поскольку критическое давление водорода составляет 12,8 атм., в настоящей работе для измерений выбрали давление 15,0 атм.
Ещё одна трудность измерений в системах твёрдое вещество — жидкость связана со сложностью отделения от насыщенного раствора мелкодисперсных взвесей исследуемого вещества. Действие этой причины снижают, как правило, использованием фильтрующих материалов, что однако, не свободно от недостатка вследствие ограниченной эффективности метода фильтрования. В настоящей работе действие этой причины исключили приготовлением растворов азота в жидком водороде, в том числе по линии фазового равновесия твёрдое вещество — жидкость, таким же методом, как и в работах [5,6].
Практически, предварительно регенерированный от влаги при 200°С силикагель марки АСМК-ВС в проточном термостатированном сосуде насыщали азотом из его смеси с водородом до определённой величины адсорбции азота. Величину адсорбции измеряли методом выходных кривых. Далее через сосуд пропускали очищенный водород при температуре опыта и давлении 15,0 атм. В процессе движения водорода через слой адсорбента в сосуде происходило его насыщение азотом до равновесной концентрации, соответствующей выбранной величине адсорбции. Если величина адсорбции изначально превышала значение предельной, то равновесная концентрация соответствовала растворимости твёрдого азота в жидком водороде при данных физических параметрах опыта. На выходе из сосуда равновесные растворы анализировали. Критерием получения растворов именно равновесного состава служила сходимость результатов измерений при различных расходах водорода через сосуд и прочих одинаковых условиях.
Анализировали равновесные растворы хроматографом «Луч-6.7» с относительной погрешностью не более 10%.
Термостатировали равновесный сосуд в криостате, в котором в качестве хладоагента использовали жидкий водород. Температуру измеряли платиновым термометром сопротивления с погрешностью 0,1 К.
Давление измеряли образцовым манометром класса точности 0,4 с верхним пределом измерений 25,0 кгс/см².
В работе использовали особо чистый азот и очищенный криоадсорбционным методом водород, содержание параводорода в котором было приблизительно 50%.
III. РЕЗУЛЬТАТЫ ИЗМЕРЕНИЙ
На рис. 1 представлены полученные в настоящей работе данные о зависимости равновесных концентраций азота в жидком водороде от его исходного содержания в силикагеле АСМК-ВС. Измерения в данной серии опытов проведены при двух температурах 20,3 К и 26,0 К и одном давлении 15,0 атм. Здесь же приведены и литературные данные аналогичных измерений в системах: СО₂ — жидкий азот — силикагель АСМК при 77,4 К и 40 атм. [6] и N₂O — жидкий кислород — силикагель ВСМ-Ш при 77,4 К и 60 атм. [5].
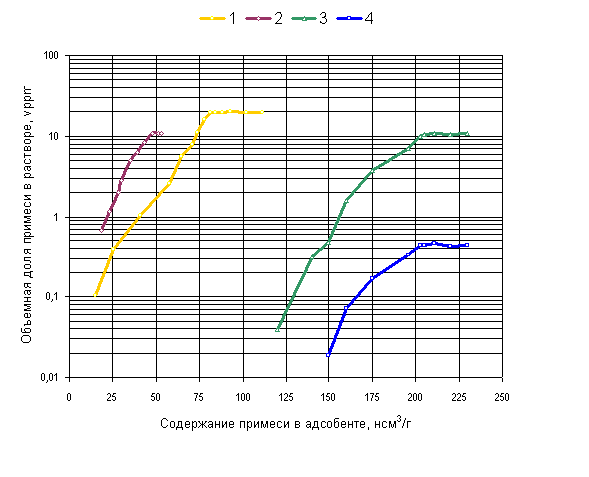
Рис. 1. Зависимость объемной доли примеси в растворе от ее содержания в адсорбенте:
1 – система СО₂ – жидкий азот – силикагель АСМК при 90 К и 40 атм. по данным [6]; 2 – система N₂О – жидкий кислород – силикагель ВСМ-Ш при 77,4 К и 60 атм. по данным [5]; 3 – система N₂ – жидкий водород – силикагель АСМК-ВС при 26,0 К и 15,0 атм. по данным настоящей работы; 4 – то же, что и 3, но при 20,3 К.
Наблюдаем, что во всех представленных на рис. 1 системах характер зависимости объёмной доли данного вещества — примеси в криогенной жидкости от его содержания в адсорбенте в качественном отношении совершенно одинаковый. В определённой точке каждая из рассматриваемых адсорбционных систем теряет одну степень свободы и переходит из три – в дивариантную. Такая потеря в соответствии с правилом фаз Гиббса связана с явлением образования новой фазы. Для нас является важным подтверждённое в работах [5,6] свойство этой новой фазы проявлять себя по отношению к равновесному объёмному раствору в количественном отношении также, как и твёрдое вещество.
Применительно к полученным данным при 20,3 К предельная величина адсорбции азота составляет 203 нсм³/г (в расчёте на нормальные условия 0°С и 760 мм. рт. ст.), а его растворимость — 0,45 ppmᵥ. При 26,0 К соответствующие значения равны 205 нсм³/г и 10,7 ppmᵥ.
Чтобы подробнее исследовать температурную зависимость растворимости, в дальнейших опытах предварительно насыщали силикагель до содержания в нём азота приблизительно 230 нсм³/г, то есть заведомо большее предельных величин адсорбции. В некоторых опытах к равновесию при данной температуре подходили как со стороны более высоких, так и со стороны более низких температур в криостате. При этом получали одинаковые, в пределах погрешности измерений, результаты.
Полученные данные представлены в таблице.
Таблица
Температурная зависимость растворимости твёрдого азота в жидком водороде при 15,0 атм.
Температура, К | Объёмная доля азота, ppmᵥ |
20,3 | 0,45 |
21,5 | 1,05 |
23,0 | 2,41 |
23,6 | 3,52 |
25,0 | 6,8 |
26,0 | 10,7 |
28,0 | 23,4 |
Каждое значение растворимости в таблице является средним арифметическим из 5…10 параллельных измерений. Относительные средние квадратические их погрешности не превышают 8%.
IV. ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
На рис. 2 приведено сопоставление полученных нами данных с данными других авторов [1, 7], Weil I., Petit VP. (цитируется по [2]) Результаты сопоставления отражают, на наш взгляд, те трудности, с которыми встречались авторы при исследовании рассматриваемой системы твёрдый азот – жидкий водород. Наблюдаемый значительный разброс данных при одних и тех же параметрах, вероятно, связан ещё и с ограниченными возможностями использованной аналитической техники. В настоящей работе в этом отношении каких-либо проблем не возникло, так как использовали хроматограф «Луч-6.7», предназначенный для подобных измерений и занесённый в Государственный реестр средств измерений под № 23889-02.
Кстати, полученные нами данные согласуются с информацией о растворимости, представленной в работе [1]. На рис. 2 информация из [1] показана в виде пунктирной линии. Максимально наблюдаемые отличия от полученных нами данных составляют 10% относительных.
Как бы там ни было, но полученные данные не должны противоречить термодинамической теории фазовых равновесий, в соответствии с которой (см. на пример [8]) при постоянном давлении ${Р}$ зависимость растворимости ${X}_{2}$ данного чистого твёрдого вещества 2 от температуры ${Т}$ передаётся уравнением:
где ${R}$ — универсальная газовая постоянная;
$\underset{\cdot}{\bar{H}_{2}}$ — парциальная мольная энтальпия вещества 2 в его бесконечно разбавленном растворе;
${H}^{0}_{2,тв.}$ — мольная энтальпия этого же чистого вещества в твёрдом состоянии.
Разность $\underset{\cdot}{\bar{H}_{2}}-{H}^{0}_{2,тв.}$ — является теплотой растворения, в нашем случае твёрдого азота в жидком водороде. Вдали от критических параметров системы (наш случай) теплота растворения практически не зависит от температуры. С учётом данного обстоятельства уравнение (1) можно проинтегрировать и путём обработки полученных данных температурную их зависимость представить в удобном для практического использования виде:
где ${X}_{2}$ — растворимость твёрдого азота в жидком водороде, ppmᵥ;
${T}$ — абсолютная температура, К.
На рис. 2 сплошная линия проведена в соответствии с уравнением (2). Вычисленное с учётом уравнения (1) значение теплоты растворения азота в жидком водороде составляет 583 кал/моль, что по знаку соответствует теплоте его сублимации, но численно приблизительную в 3 раза меньше.
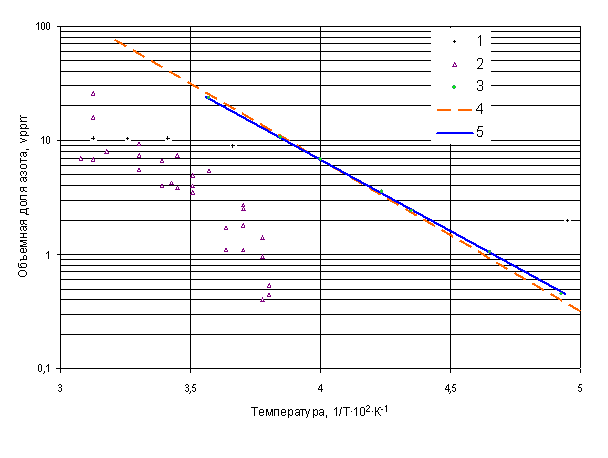
Рис. 2. Зависимость растворимости твердого азота в жидком водороде от температуры:
1 - данные Weil I., Petit P. (по [2]) при 15 атм.; 2 – данные [7]; 3 – данные настоящей работы при 15 атм.; 4 – информация из [1]; 5 – расчет по формуле (2).
Таким образом, полученные в настоящей работе экспериментальные данные по растворимости твёрдого азота в жидком водороде можно отнести к термодинамически согласованным и рекомендовать для практического использования, в том числе и для оценок процессов при давлениях меньших 15,0 атм. Последнее следует из относительно слабой зависимости растворимости твёрдых веществ в жидкостях от давления в области умеренных давлений [9] вследствие относительно малой сжимаемости жидкостей.
На рис. 3 представлены расчётные данные о возможном количестве растворённого азота в каждой тонне жидкого водорода в зависимости от его температуры.
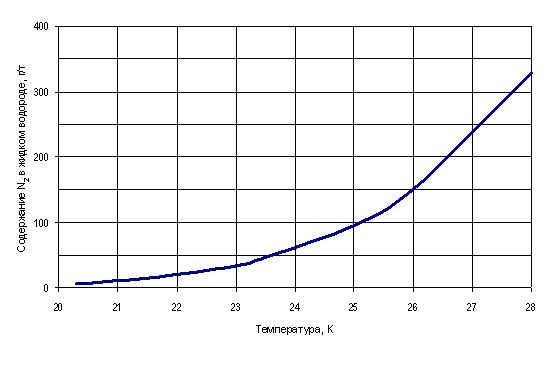
Рис. 3. Зависимость возможного содержания азота в 1 тонне жидкого водорода от его температуры
При температуре, например, 28,0 К (избыточное давление приблизительно 5,0 кгс/см²) это количество составляет приблизительно 328 г. При температуре 20,3 К (атмосферное давление) – 6,3 г. Следовательно, каждая тонна загрязнённого до уровня насыщения при 28,0 К жидкого водорода при последующем охлаждении до 20,3 К, например, сбросом его избыточного давления выделит в твёрдом виде приблизительно 322 г азота. Так как плотность твёрдого азота при 20,66 К составляет 1,03 г/см² [3], то указанное количество азота соответствует его объёму 313 см³ и может составить определённые проблемы для импульсных трубок или запорной арматуры. Такие вероятные «фокусы» не могут устраивать потребителей жидкого водорода. Отсюда вытекает необходимость установления норм содержания азота в жидком водороде при его производстве в качестве криопродукта. Очевидно, объективный аналитический контроль качества жидкого водорода возможен лишь в ситуации, когда численное значение устанавливаемой нормы меньше значения растворимости. Насколько меньше? Это зависит от уровня аналитической техники и допускаемой степени риска, рассмотрение которых не входило в задачи настоящей работы.
Здесь представляется целесообразным остановиться на рассмотрении одной из возможных ситуаций, когда по каким-либо причинам получили загрязнённый азотом жидкий водород. Представленные выше данные по адсорбционным равновесиям (см. рис. 1) показывают, что использование метода адсорбции для очистки жидкого водорода от азота может быть эффективным. Так, для очистки одной тонны жидкого водорода при 20,3 К, исходя из условий равновесия, потребуется всего 28 г силикагеля АСМК-ВС. То же при 26,0 К – приблизительно 670 г.
V. ЗАКЛЮЧЕНИЕ
Известные, в общем-то, трудности исследования фазовых равновесий в криогенных системах применительно к системе твёрдый азот – жидкий водород привели к «наводнению» справочных изданий противоречивыми данными. Так в действительно уважаемом справочнике [3] (стр. 201) содержится буквально следующее: «Грубая экстраполяция показывает, что растворимость азота при 20 К в жидком водороде должна быть не меньше 10⁻⁸ доли… По экспериментальным определениям растворимость азота в жидком водороде при 20 К менее 10⁻⁸».
Как показывают результаты выполненных в настоящей работе исследований, действительные значения растворимости азота в жидком водороде составляют весьма заметные значения. Численные их значения необходимо учитывать как на стадии производства жидкого водорода в качестве товарного криопродукта, так и на стадиях обращения с ним (транспортировки, хранения, применения).
Жидкий водород, загрязнённый азотом, поддаётся очистке адсорбционным методом.
ЛИТЕРАТУРА
1. Khristenko Yu., Tomilin V. The safety provision during venting of gaseous hydrogeg to atmosphere at the liquid propellant roket engine test stand complex using LH2+LOX.// International Journal of Hydrogen Energy.-1999.-№ 24.- p.677-685.
2. Свойства жидкого и твёрдого водорода. Есельсон Б.Н., Благой Ю.П., Григорьев В.Н. и др. Справочный обзор, № 1.-М: Издательство стандартов. 1969. – 136 с.
3. Справочник по физико-техническим основам криогеники. Под редакцией М.П. Малкова/ М.П. Малков, И.Б. Данилов, А.Г. Зельдович и др.-М.:Энергия, 1973. – 392 с.
4. Справочное издание Водород. Свойства, получение, хранение, транспортирование, применение. Гамбург Д.Ю., Семёнов В.П., Дубовкин Н.Ф. и др. – М.: Химия.-1989.-672 с.
5. Морозов В.С., Морозов Д.В. Адсорбционная очистка жидкого кислорода от закиси азота // Технические газы – 2003.-в печати.
6. Богуславский С.В., Зайцев С.В., Морозов В.С. и др. Адсорбция двуокиси углерода из жидкого азота на силикагеле АСМК // Журнал физической химии.-1985.-Т.59.-№1. – с. 132-134.
7. Omar M.H., Dokoupil Z. Solubility of nitrogen and oxygen in liqud hudrogen at temperatures between 27 and 33 K// Physica.-1962.-28.-p.461-471/
8. Кричевский И.Р. Фазовые равновесия в растворах при высоких давлениях.-М.-Л.: Госхимиздат, 1952.-с. 168.
9. Кирилин В.А., Шейндлин А.Е., Шпильран Э.Э. Тремодинамика растворов.- М.: Энергия._ 1979.288 с.
Цены на водород ОСЧ по ТУ 2114-016-78538315-2008 «Водород особо чистый»
- Марка А (99,99999 %об.)1750 ₽ за м³
- Марка Б (99,9999 %об.)1460 ₽ за м³
- Марка В (99,999 %об.)1110 ₽ за м³
- Подготовка баллона к заполнению водородом марки А5016 ₽
- Подготовка баллона к заполнению водородом марки Б4218 ₽
- Подготовка баллона к заполнению водородом марки В2679 ₽
- Цены приведены с учетом всех налогов и сборов
